BOLETIN IFI
Cirrosis Biliar Primaria (CBP)
Dr. Samuel Katz
|
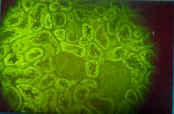 |
Fotografía 1: Imagen de AMA en riñón perteneciente a los cortes de triple tejido HRE Ififluor Multitest. Se observa una intensa fluorescencia en los túbulos renales, mientras que los glomérulos no se marcan. Este suero fue procesado siguiendo la técnica normal indicada en el protocolo del equipo. Se recomienda utilizar color de alta densidad (16 bits) en la placa de video de su computadora para una correcta visualización de las imágenes. |
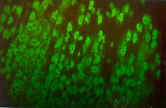 |
Fotografía
2: Imagen de AMA en estómago perteneciente a los cortes de triple tejido HRE
Ififluor Multitest. Se observa una intensa fluorescencia en las células
parietales gástricas. Este suero fue procesado siguiendo la técnica
normal indicada en el protocolo del equipo. |
Anticuerpos AMA en el diagnóstico de la CBP
Dr.
Samuel Katz
Director Laboratorio IFI
La
detección de anticuerpos anti-mitocondriales
(AMA) constituyen la prueba más sensible y específica para el
diagnóstico de la cirrosis biliar primaria.
El primer diagnóstico de una cirrosis
biliar primaria con comprobación quirúrgica e histopatológica en
nuestro país fue efectuado en la Facultad de Farmacia y Bioquímica de la
Universidad de Buenos Aires por el subscripto.
Empleamos la técnica de inmunofluorescencia indirecta con improntas de
cortes de tejido de estómago, riñón e hígado. Se observa con el
microscopio de UV intensa fluorescencia en las células parietales gástricas
y en los túbulos renales. La tinción no es órgano ni especie específica
pudiéndose observar fluorescencia con distinta intensidad en distintos
tejidos y especies dependiendo de la riqueza mitocondrial. Con el empleo
de células Hep-2 se observa tinción en el citoplasma requiriendo cierta
experiencia el reconocimiento
de la patente.
Con la técnica de IFI que
empleamos de rutina la sensibilidad y especificidad oscila alrededor del
95%.
Se han desarrollado técnicas de ELISA e inmunoblotting. Empleamos la técnica
de ELISA para el diagnostico del antígeno M2 pero siempre corroboramos
el diagnóstico con la técnica de IFI.
Los principales autoantígenos están en la membrana interna de las
mitocondrias y son componentes del complejo de la oxo dehidrogenasa. Las
tres subunidades del complejo de la oxodehidrogenasa son:
1)
Piruvato dehidrogenasa E2 (PDC-E2)
2) Cadena ramificada del complejo E2 (BCOADC-E2)
3) 2-oxo glutarato dehidrogenasa complejo
E2 (OGDC-E2)
PDCE2 ha sido implicado como el antígeno mas importante en la patogenesis
de la CBP.
El antígeno M2 corresponde a la enzima 2 oxo ácido dehidrogenasa.
Actualmente se considera a la CBP como un modelo de enfermedad autoinmune
estando los autoantígenos en
los hepatocitos y en los conductos biliares.
Previamente a la identificación de los principales antígenos de la CBP
se dividían a los anticuerpos antimitocondriales
en
9 subtipos consideradas por Schoenfeld
(The Decade of Autoinmunity, Elsevier) como diagnosticados con técnicas
inespecíficas. Entre ellos el antígeno M2 que corresponde a la 2 oxo-ácido
dehidrogenasa.
Están descriptas en la CBP dos tipos de patentes anti-nucleares :
1.Patente moteada (dots) que corresponde a las proteínas Sp100 y PLM.
2.Patentes nucleares periféricas, presenta dos patentes típicas: una de
aspecto liso que corresponde al receptor de laminina B y otra de aspecto
punteado que corresponde a los poros de la membrana nuclear.
3.Anticuerpos anti-plaquetas se han descripto en el 40% de las CBP.
Se han descripto pacientes con fosfatasa alcalina normal y AMA positivo
encontrándose en la mayoría daño histológico similar a los encontrados
con la CBP.
Un
porcentaje de pacientes con AMA negativos y con fosfatasa alcalina
elevados e histología de CBP suelen tener anticuerpos antinucleares
positivos. Se denomina esta patología
Colangitis
Autoinmune, que suele tener asociados anticuerpos anti-músculo liso (ASMA).
Con un titulo de AMA mayor a 1/40 suele no ser necesaria la biopsia hepática
para el diagnóstico de CBP.
La CBP se suele clasificar en 4 estadios:
-
Hepatitis portal con destrucción de conductos biliares.
-
Hepatitis periportal y proliferación biliar.
-
Septos fibrosos y necrosis en puentes.
-
Cirrosis
Recomendaciones
para el diagnóstico de CBP:
1.En pacientes con fosfatasas alcalinas séricas elevadas sin clara
explicación se recomienda estudiar los anticuerpos anti-mitocondriales.
2.AMA
> de 1/40 con signos de colestasis sospecha firme de CBP.
3.AMA+ con fosfatasa alcalina normal se debe controlar periódicamente.
4.Con anticuerpo anti-células parietales (APCA) positivos en IFI se
recomienda siempre investigar fluorescencia en túbulos renales. La
asociación de estos dos anticuerpos suele indicar CBP.
Lecturas recomendadas:
1.Kaplan
MM. Primary
Biliary Cirrhosis.N.Engl.J.Med 1996:335:1570
2.Christopher T. And all. The Antigens of Primary Biliary Cirrhosis: Who
are they and Where Do They come from.The Decade Of Autoimmunity Y.
Schoenfeld.Elsevier.1999
3.Shaffner ,F. Primary Biliary Cirrhosis .Clin Gastroent 1975;4:351
4.Marshall M Kaplan .Pathogenesis of Primary biliary cirrhosis
Nov.1 2000 UpToDate Vol.9.1 Hepatic diseases
Preguntas Frecuentes
Esta
sección tiene por objetivo comentar una serie de preguntas frecuentes
que llegan a nuestro Laboratorio, acerca de las técnicas de
inmunofluorescencia en general
P: ¿El título recomendado para diluir la antigamma es el óptimo para cualquier laboratorio?
R:
El título que se recomienda es el óptimo para un sistema de microscopía
y lámpara en perfecto estado de funcionamiento. En el caso de una lámpara
UV que ha superado su vida útil o si el microscopio tiene su sistema óptico
en malas condiciones (no alineado, con suciedad, etc.) se verificará una
disminución de la intensidad de la fluorescencia al título recomendado.
Se recomienda ajustar el microscopio o cambiar la lámpara pero sin
modificar la dilución indicada de la antigamma
P:
¿Puedo conservar la antigamma ya diluída?
R:
No. La antigamma debe ser preparada en el momento para cada ensayo y
conservada protegida de la luz.
P: Recibió las improntas el servicio de farmacia y no las conservó a –20C, sino que las colocaron en la heladera. ¿Eso las inutiliza?
R:
No. Las improntas se pueden utilizar ya que han sido adaptadas para ser
conservadas en heladera durante un tiempo prudencial, sin que esto afecte
la performance del equipo. Cada lote de improntas es chequeado para
asegurar una buena conservación durante el tiempo de transporte hasta su
llegada al laboratorio.
P: El control de calidad en el que enrolé a mi laboratorio me pide información acerca de la estandarización de los kits que utilizo. ¿Cómo se estandarizan los kits que produce el Laboratorio IFI?
R:
Los kits que produce nuestro laboratorio están estandarizados frente a
controles provistos por el Centers for Disease Control (CDC) de Estados
Unidos. De la misma forma los controles positivos y negativos están
referenciados contra esos controles.
Envío de muestras para evaluacion
Cualquier laboratorio que utiliza
nuestros kits puede enviarnos muestras de sueros con resultados
complejos o discordantes entre diferentes técnicas. El servicio es
gratuito para los laboratorios que utilizan kits producidos por
Laboratorio IFI. Antes de enviar la muestra le requeriremos la siguiente
información:
-
Diagnóstico presuntivo
-
Antecedentes clínicos y de laboratorio del paciente
-
Resumen de los resultados obtenidos por el laboratorio
-
Condiciones en las que se realizó la técnica de IFI (controles, antigamma, microscopio, etc.)
Boletín IFI es una publicación bimensual de Laboratorio IFI, de distribución gratuita entre los laboratorios que realizan ensayos de inmunofluorescencia. El objetivo de este boletín es promover la interacción y la comunicación entre los laboratorios. LABORATORIO IFI- Chile 523 -1603 Villa Martelli - Buenos Aires - Argentina. Tel: (011) 4730-4211 Tel/Fax: (011) 4761-8831